PNAS: 这些病毒是原生动物基因组中的偷渡者

在对复杂单细胞微生物进行大规模研究时,奥地利因斯布鲁克大学生态学系的Christopher Bellas博士、Marie-Sophie Plakolb和Ruben Sommaruga教授发现了一个意外情况:微生物的基因组中找到超过30,000种先前未知的病毒DNA。这种“隐藏”的DNA可能允许宿主细胞复制产生功能完整的病毒。
“我们对分析中发现的病毒数量感到非常惊讶,”Bellas说。“在某些情况下,一个微生物的基因组DNA中高达10%是内源性病毒。”这些病毒似乎不会危害宿主。相反,甚至可能保护它们。许多看起来类似于所谓的噬病毒体(virophages)。这些病毒可感染并摧毁感染宿主细胞的其他有害病毒。
这项由奥地利科学基金(FWF)资助的研究在《Proceedings of the National Academy of Sciences 》(PNAS)杂志上发表。
病毒作为保护者
从细菌到人类,所有生命形式都不断受到病毒感染。有些病毒一直存在,但只偶尔引发症状,例如人类的疱疹病毒。其他病毒则更深入地隐藏,成为宿主的DNA的一部分。这项研究发现,地球上很多单细胞真核生物(复杂生物)中存在许多病毒。这些生物无处不在,包括湖泊和海洋中丰富的藻类、土壤中的变形虫以及人类的寄生虫。
“为什么微生物的基因组中会有这么多病毒序列尚不清楚。” Bellas说,“我们认为最可能的假设是它们通过保护细胞免受危险病毒的感染来保护细胞。”许多单细胞真核生物会被“巨型病毒”感染,这是一类大小可与细菌相当的病毒。这些感染会会创建巨型病毒的新副本,进而杀死宿主。然而,当噬病毒体(virophage)驻留在宿主细胞中时,它会“重新编程”巨型病毒以构建噬病毒体。因此,有时巨型病毒可以被抵御,并使宿主细胞群免于破坏。
新发现的病毒DNA与噬病毒体DNA相似。因此,宿主微生物可能通过这些内置病毒保护自己免受巨型病毒的侵害。
来自高山湖泊的DNA
该研究项目最初是基于Bellas和Sommaruga在2021年在奥地利蒂罗尔州的Gossenköllesee水域发现的一类新病毒。Bellas解释说:“最初,我们想通过研究找到新'Polinton-like病毒'的起源。但是,我们不知道这些病毒通常感染哪些生物。因此,我们进行了一项大规模研究,测试了所有已知DNA序列的微生物。”

最终,研究人员发现了比他们寻找的病毒更多的东西。这个意外的发现将启发更多研究以探索这些病毒发挥的作用。

意义:
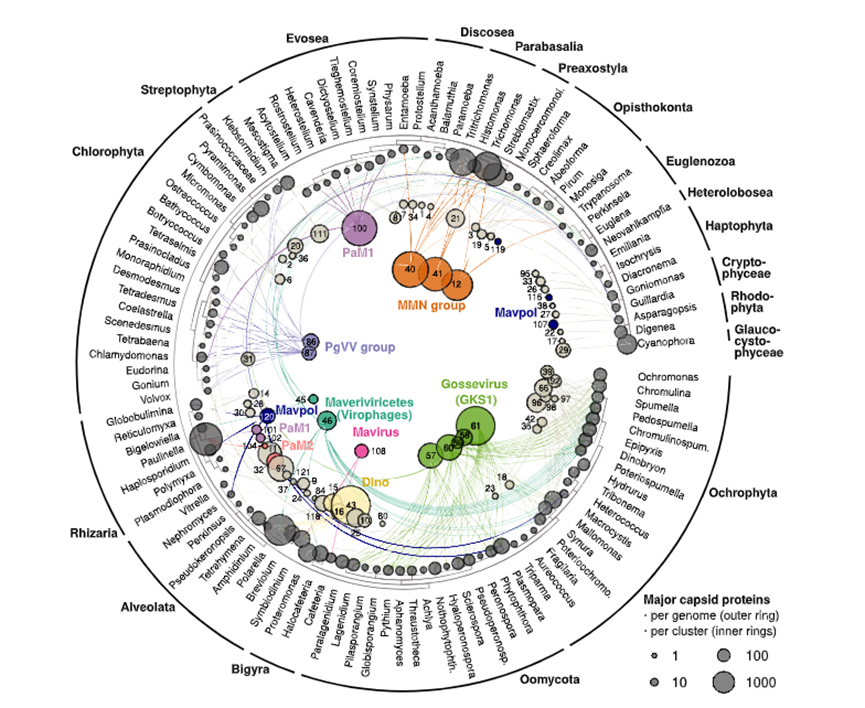
原生生物是一类多样化的单细胞真核生物,不属于动物、植物或真菌。它们占据了真核生命树的大部分,是几乎所有生态系统的主要组成部分,并对碳和营养循环至关重要。在这项研究中,我们发现原生生物基因组的大部分来自病毒DNA,并且这些病毒整合在规模上与原噬菌体在细菌基因组中整合相当。原生生物的内源性病毒元件(EVEs)与噬病毒体在进化上亲缘关系较远。许多EVEs看起来像功能性病毒,这表明这些病毒元件的多样化排列可能是宿主抗病毒系统的一部分。
摘要:
真核生物基因组包含各种内源性病毒元件(EVEs),它们大多来自没有功能的RNA和ssDNA病毒,被认为是“基因组化石”。然而,对EVEs的基因组调查发现,在动物和植物中EVEs差异很大,而在代表大多数真核生物多样性的原生生物基因组中研究较少。在这里,我们展示了原生生物基因组中含有数十个到数千个多样化的、长约14到40 kbp的双链DNA病毒序列。这些EVEs由病毒、Polinton-like病毒和相关实体(entity)组成,由于病毒组之间的序列保守性差、存在重复序列,很难利用短序列进行基因组的组装。我们发现长序列测序技术(long-read sequencing)对于解决病毒插入是理想的测序方法。许多原生生物EVEs似乎是完整的,大多数编码整合酶,这表明它们已经在真核生命树的各个分支中积极定植于宿主。我们还发现宿主转录组中存在这些基因的表达,并且其与宏病毒组中噬病毒体和Polinton-like病毒基因组的丰度密切相关,这表明许多EVEs可能是功能性病毒。
点击阅读原文:
https://www.sciencedaily.com/releases/2023/04/230411105915.htm
查看原文信息:
https://www.pnas.org/doi/10.1073/pnas.2300465120
往期精品(点击图片直达文字对应教程)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
机器学习
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集

































