fMRI研究 | 社交情境下的混合情绪

导读
背景:神经科学通常都是单独研究各种情绪,而混合的情绪状态(例如愉悦和厌恶、悲伤和快乐的共存)在日常生活中很常见。心理生理学和行为学证据表明,混合情绪可能具有不同于其组成情绪的反应特征。然而,混合情绪的大脑基质仍有待解决。
方法:本研究招募了38名健康成年人,通过让他们观看经过验证的短片,从而引发积极(愉悦)、消极(厌恶)、中性或混合(愉悦和厌恶的混合)的情绪状态,同时用功能性磁共振成像(fMRI)来评估他们的大脑活动。本研究通过两种方式来评估混合情绪:首先,对模糊(混合)和明确(积极和消极)的电影片段的神经反应进行比较,其次,通过进行参数分析来测量与个体情绪状态相关的神经反应。因此,在每个片段后都获得了愉悦和厌恶的自我报告,并计算出一个最低感觉分数(愉悦和厌恶共存的最低分)来量化混合的情绪感受。
结果:两项分析都显示,后扣带回(PCC)、内侧上顶叶(SPL)/楔前叶和顶枕沟网络参与了引发混合情绪的模糊情境。
结论:本研究结果首次揭示了参与动态社会模糊性处理的专用神经过程。这表明,在处理混合情绪的社交场景中可能需要高阶层(SPL)和低阶层(PCC)共同参与加工过程。
引言
混合的情绪状态在日常生活中很常见。然而,迄今为止的研究主要是研究相对纯粹的情绪状态。这使得我们不清楚应该如何将混合的情绪状态概念化。尤其是,模棱两可的社会行为会引发我们内心冲突性的社会情绪反应。例如,一个人踩在香蕉皮上滑倒的经典闹剧场景,既会让人们对这个人在着地时可能经历的疼痛产生排斥,也会让人们对这个人试图保持直立时的无助感到好笑。然而,尽管如此,情感科学中的情绪处理往往是以分类理论方法来进行研究的,而更复杂的情绪,如混合情绪状态,仍然没有得到解决。本研究试图填补这一空白,因而还考虑了竞争的情绪理论,这些理论提出了对混合情绪的不同解释。
混合情绪:理论预期
根据经典的情绪环状模型,情绪的产生取决于效价(从负性到正性)和唤醒(从低到高)两个正交的双极性维度。因此,从理论上讲,积极和消极的情绪状态是相互排斥的。由此,不同的解释提出,混合情绪(即同时经历相反的情绪)反映了其纯粹的情绪组成之一。另一方面,据某些评估理论家的观点,混合的情绪状态是由其纯粹的构成成分发展而来的,发展过程中不适当的倾向最终会消失,而主导反应也会减弱。因此,这种加性解释可以预测混合情绪状态相对于其纯组成情绪的强度差异。然而,其他评估理论认为,混合情绪状态反映了一个不同的情绪过程。在这种解释下,混合情绪状态的模式将与其纯组成情绪分离,从而产生独特的情绪轮廓。
混合情绪:实证结果
混合情绪状态的初步心理生理学证据支持涌现说,这些发现在之后的独立研究中得到了证实。Kreibig等人(2013, 2015)使用标准化的电影片段,收集了15个不同的生理参数(包括面部肌电图、心率变异性、血压、皮肤温度和呼吸),同时引发了愉悦、厌恶和混合情绪(即愉悦和厌恶)。对面部表情的分析表明,在混合情绪状态下,微笑(颧大肌)和皱眉(皱眉肌)的共同激活与愉悦时的简单微笑激活和厌恶时的简单皱眉激活不同。自主反应分析表明,混合情绪状态下的反应特征在强度和模式上都不同于单一情绪状态下的反应特征。综上所述,这表明混合情绪状态具有独特的生理反应。然而,到目前为止,这种分析还未在大脑中进行,这可能揭示了一种由冲突情绪引起的模糊性神经模式。也就是说,迄今为止还没有一项研究调查同时经历混合情绪时的神经反应,而混合情绪的效价是截然相反的。最小感觉是一种操作混合情绪状态的最佳测量方法。但问题是,两种情绪的共享是否与其基本情绪状态有本质的区别或重叠。
模糊性具有冲突和不一致的特征,这两者都需要多个认知-情感过程,其中包括与反应抑制、情绪调节和心理灵活性相关的执行功能,以最终消除这些冲突信息。现有的神经影像学文献表明,无论是消除社交性还是非社交性的视觉线索歧义,都会引发归因于执行控制的特定神经区域的活动。例如,识别情绪模糊的面孔表情会激活与反应抑制相关的外侧额叶区域,而非社交感知模糊期间的任务转换会引发双侧内侧后顶叶(即楔前叶)活动,这是一个与自我反思记忆和认知灵活性相关的区域。总之,消除社交和非社交视觉线索的歧义,可能与情感和执行处理以及记忆需求的增加有关。
社会神经科学已经开始研究这样的神经系统,即通过组合冲突性的情感元素来处理情感模糊的社会情境,也就是说两个不适当或意外的情境元素同时出现。比如所处的社会环境具有冲突性(例如,积极浪漫的场景和悲伤的音乐)或所传达的情绪具有冲突性(例如,他人以友好的声音交谈时造成痛苦)。这种刺激可能会引起混合情绪。Rohr等人(2016)展示了情绪冲突的社交场景,并测量了与情绪冲突主观评分有关的血氧水平依赖(BOLD)反应。参与者指出这些场景对他们来说情感冲突的程度。研究结果发现,当感知冲突增加时,楔前叶、颞上沟和额上沟的神经活动更大。此外,情绪冲突呈现出一种相对复杂的情感状态,可能难以直接探究。因此,直接确定自己的混合情绪体验可能容易产生主观偏见。然而,计算一个最低分值将反映出同时感知到的两种基本情绪(例如,愉悦和厌恶)的最低共享值。因此,让参与者评估他们对愉悦和厌恶的感知,比要求他们评估对两者混合的感知更简单。但迄今为止,还没有研究调查在复杂情绪的社交情境下神经加工的特异性。
研究现状
本研究的主要目的是测试混合情绪的神经特异性,因为它们与纯粹的情绪成分有关。第二个目的是测试在观看社交场景时,增加的混合情绪对BOLD变化的调节程度。针对第一个目的,本研究通过fMRI检查了BOLD活动,同时参与者观看了描述社交场景的动态短片,其中具有不同程度的有趣和令人恶心的元素(即模糊的社交情绪场景),这些场景此前已被证明会引起复杂的情绪。本研究测量了三个主要效应:(Ⅰ)情绪;(Ⅱ)混合情绪;(Ⅲ)效价。就情绪而言,本研究比较了引起一种主要情绪(例如,愉悦、厌恶)的社会情绪电影片段和没有明显情绪(即,中性)的社会电影片段的BOLD激活情况。对于混合情绪,本研究将混合情绪电影片段引起的BOLD激活与观看明确(一种主要情绪)和中性电影片段时的BOLD激活进行了比较。最后,对于效价,本研究比较了观看有趣的电影片段和恶心的电影片段时的BOLD变化。针对第二个目的,本研究对每个电影片段进行了愉悦和厌恶的自我报告测量。通过计算最小感觉分数(MinFeel)来表征混合情绪,即愉悦和厌恶分数之间共享的最小自我报告值。也就是说,对于每个参与者和电影片段,都计算出一个反映自我报告的愉悦和厌恶共同激活的混合情绪指数。该指数是基于两种情绪中较弱的情绪强度来计算的,即I[MF]=最小值(I[AMU],I[DIS]),其中I[MF]:混合情绪强度,I[AMU]:体验到的愉悦感的强度,I[DIS]:体验到的厌恶感的强度。值大于零表示存在混合情绪。然后用MinFeel分数对BOLD激活进行回归。
对于混合情绪,本研究预测在与注意力、工作记忆和认知灵活性有关的神经区域内,特别是外侧额叶区和内侧后顶叶区,对混合社会场景(即与纯粹的情绪[积极或消极]场景对比时)有不同的活动。对于第二个目的,本研究假设情绪模糊性不断增加的社会场景(根据MinFeel测量指标,愉悦和厌恶的混合程度不断增加)会对这些额叶和顶叶区域内的神经活动产生正向参数调节。
值得一提的是,本研究是一项大型研究的组成部分,该研究考察了在经历混合情绪时情绪调节的影响。本研究的主要目的是在没有明确的调节机制参与的情况下,对混合情绪的神经加工进行评估。因此,对混合情绪的情绪调节分析将单独报告。
材料和方法
参与者
最初在斯坦福大学校园里用传单招募了48名健康参与者。纳入标准是参与者无(自我报告的)精神或神经疾病。所有参与者的排除标准包括既往头部创伤和任何MRI安全前提的禁忌症(如体内有金属物体)。所有参与者的视力正常或矫正至正常。所有参与者均签署知情同意书。本研究得到了大学机构审查委员会的批准。
最终有8名参与者的数据因为过度的运动伪影(即头部突然移动超过3个体素)而被剔除,有2名参与者因为技术错误导致MRI数据丢失/无效而被剔除。最终纳入38名参与者的数据(20名女性,平均年龄21.61岁,标准差±2.61岁,范围18-31岁)。
实验任务
本研究的刺激物来自Samson等人(2016)的电影剪辑库,其中包含持续20-30秒的短片,主要引起积极(愉悦)、消极(厌恶)、混合(愉悦和厌恶混合)和中性情绪。如前所述,本研究是一项更大的实证研究的一部分,其目的也是为了确定引起混合情绪的神经关联。然而,在本研究中,研究者首先希望在不考虑情绪调节的情况下,建立对混合情绪的神经反应的基本理解。因此,将重点分析积极、消极、混合和中性电影片段的自然观看指令,而不分析混合电影片段与两种不同情绪调节指令配对的额外条件:(i)关注积极元素和(ii)关注消极元素。总体而言,该研究的设计是一个不完全交叉的4(电影类型:积极、消极、混合、中性)×3(指令类型:自然、关注积极元素、关注消极元素)被试内设计。对12段积极、12段消极和12段中性电影片段仅给予自然观看指令,而对36段混合情绪电影片段则给予三种类型的观看指令(其中,12段给予自然观看指令,12段给予关注积极元素的指令,12段给予关注消极元素的指令)。虽然本研究将重点放在自然观看条件的分析上,但将所有试次(自然和调节)都纳入了fMRI的一级分析,并将调节试次(即2个条件,24个电影片段)作为不感兴趣的协变量,以控制任何可能由情绪调节解释的方差。
该实验共包括6个run,每个run的时间最长为11.6分钟。在6个run中,总共有72个20-30秒长的电影片段,其中2个电影片段是从6个条件中随机抽取的,并按随机顺序呈现。72个试次中的每个试次都由一个5秒的十字注视点,8秒的指令呈现,20-30秒的电影片段,以及15秒的自我报告评估,评估的内容包括愉悦、厌恶以及应用观看指令的效果(将在其他地方报告)。每个评估内容有5秒钟的时间。
行为测量
在观看每段电影后,要求参与者对电影片段有趣(愉悦)和恶心(厌恶)的程度进行评分。在5点李克特量表中,评分范围为1(非常低)到5(非常高)。计算最低感觉(MinFeel)得分,以确定在每个电影片段中体验到混合情绪的程度。这是通过计算愉悦和厌恶得分之间的最小共享分数来实现的。例如,如果参与者对某一特定电影片段的愉悦感是3分,厌恶感是5分,那么MinFeel得分将是3分,因为它是愉悦感(3)和厌恶感(5)之间的最小共同得分。因此,MinFeel得分越高,愉悦和厌恶混合情绪的强度就越大。
为了确定在不同条件下感知到的愉悦和厌恶的显著变化,本研究对被试内因素电影片段(积极,混合,消极,中性)和情绪(对每个电影片段类型分别进行愉悦和厌恶的平均情绪评分)进行重复测量方差分析。作为操作检验,随后对MinFeel评分进行重复测量方差分析,调查了电影类型的主效应,以确定相对于纯粹的情绪电影片段,混合情绪电影片段是否引起了明显更大的混合情感(即在MinFeel测量中的得分更高)。使用社会科学统计软件包(SPSS,v17)进行分析。
fMRI
采用3-T扫描仪(GE Discovery MR750)和32通道Nova Medical头部线圈,以及T2*敏感梯度回波平面成像(EPI)序列获取脑功能图像,从41个斜位切片(TR=2000ms,TE=30ms,体素大小为2.9mm3,77°翻转角,FOV=24.9cm2,86×86采集矩阵,2.9mm层厚,无间隙)中获得6个run的390个功能体积。使用泡沫填充物来最小化头部运动。采用3D快速扰相梯度回波反转恢复(IR-Prep)序列(TR=6.96,TE=2.61,反转时间=450ms,体素大小1mm3,12°翻转角,FOV=24.0cm2,240×240采集矩阵,160个轴向层,1mm层厚)获取高分辨率T1加权图像进行解剖归一化。图像处理和统计分析是在日内瓦大学Baobab集群上使用高性能计算机进行的,该集群是高级科学计算的专用资源。
采用SPM12(www.fil.ion.ucl.ac.uk/spm)对fMRI数据进行预处理。首先为每个参与者的fMRI数据设计了两个主要的一般线性模型。第一个模型旨在研究电影片段的主效应(积极、混合、消极、中性)。第二个模型用于测量诱发主观感受(愉悦、厌恶、MinFeel)的参数调节(PMOD)。对于电影片段分析,使用六种不同时长的电影片段条件设计了一级模型。四种类型电影片段与自然观看指令配对:①积极的;②混合的;③消极的;④中性的。由于这项研究是嵌套在一个正在进行的关于情绪调节的大型研究项目中,另外两个条件与情绪调节指令配对。鉴于情绪调节不在本研究的范围内,这两个条件没有在第二层次上进行建模。相反,它们作为不感兴趣的回归变量,因此提高了本研究模型的精度。
研究结果
行为测量
在检查自我报告情绪量表时,观察到电影类型的主效应显著(p<.001),其中中性电影片段的厌恶程度明显低于积极、混合和消极的电影片段。情绪的主效应不显著(p=0.374),因此参与者总体上并没有感觉到电影片段更有趣或更厌恶。电影类型与情感存在交互效应(p<.001),即积极的(即有趣的)电影片段被认为比消极的(即厌恶的)电影片段更有趣、更不恶心,反之,消极电影片段被认为比积极电影片段更不有趣且更厌恶(图1A)。然后,对MinFeel得分进行重复测量方差分析,结果发现电影类型的主效应显著(p<.001),其中混合情绪电影片段引起的MinFeel(1.93±0.51)明显高于积极(1.31±0.23)、消极(1.46±0.53)和中性(1.05±0.09)电影片段(图1B)。后者的发现证实了混合情绪电影片段成功地引发了更复杂的情感(即模糊性)。
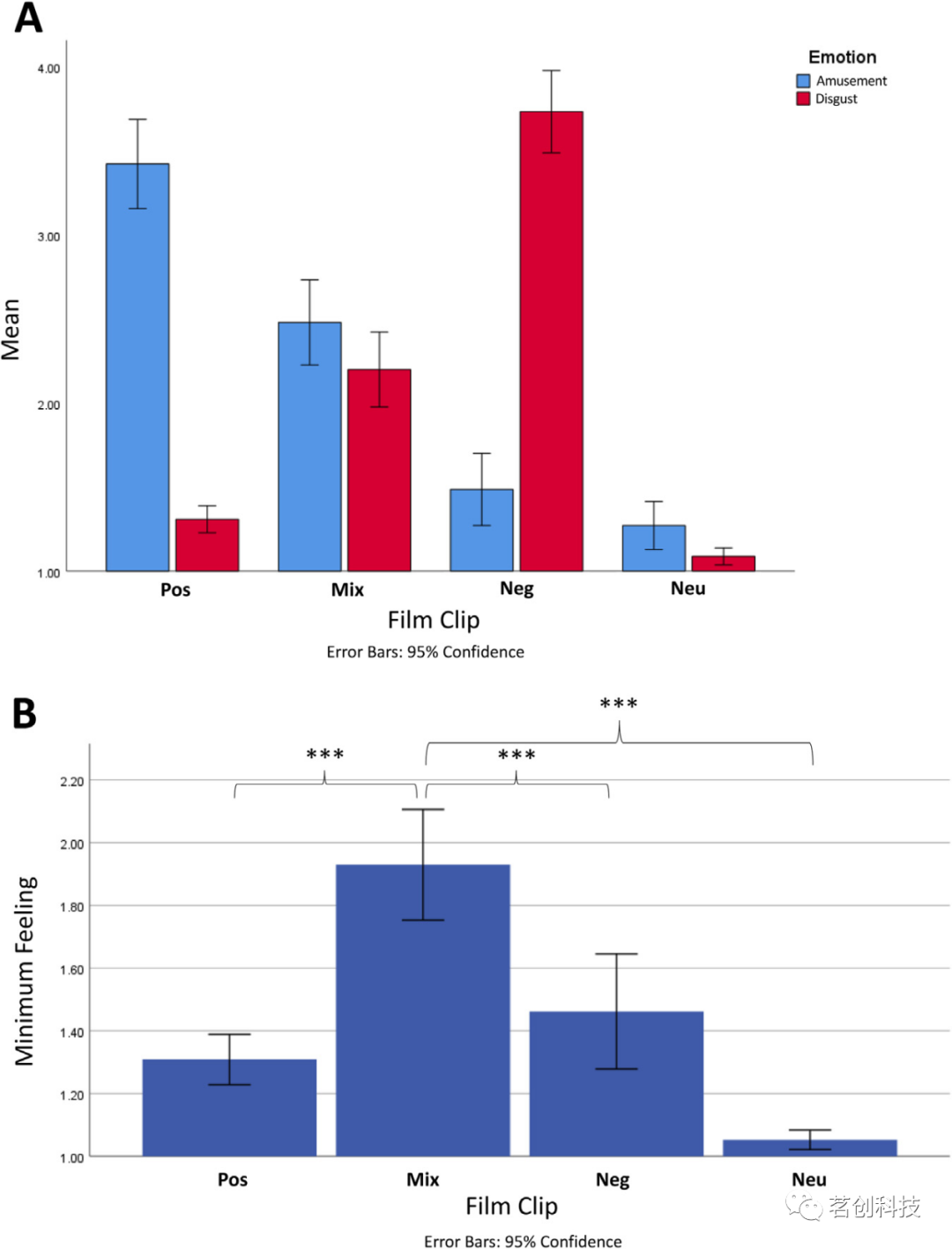
图1.四种电影片段类型条件(积极、混合、消极和中性)下的愉悦、厌恶和最低感觉的平均评分。
fMRI
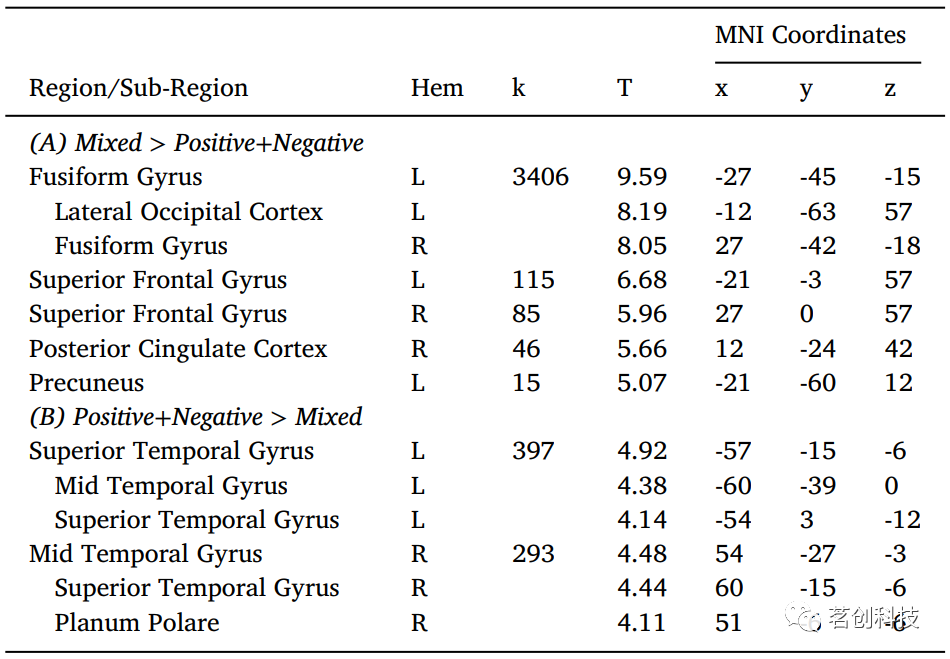
与中性条件相比,混合情绪电影片段在额下回(IFG)、颞极、SFG、脑干、MTG、TPJ、小脑、梭状回和舌回引发了更大的活动(p-FWE<0.05)。然而,当直接比较(混合)和纯(积极+消极)电影片段时,结果显示SFG、楔前叶和后扣带回皮层(PCC)的神经活动显著增加(图2A,表1A)(p-FWE<0.05)。相反,与混合情绪电影片段相比,纯(积极+消极)电影片段在颞上回和颞中回(STG和MTG)引起了更大的神经活动(图2B,表1B)(p-FWE<0.05)。
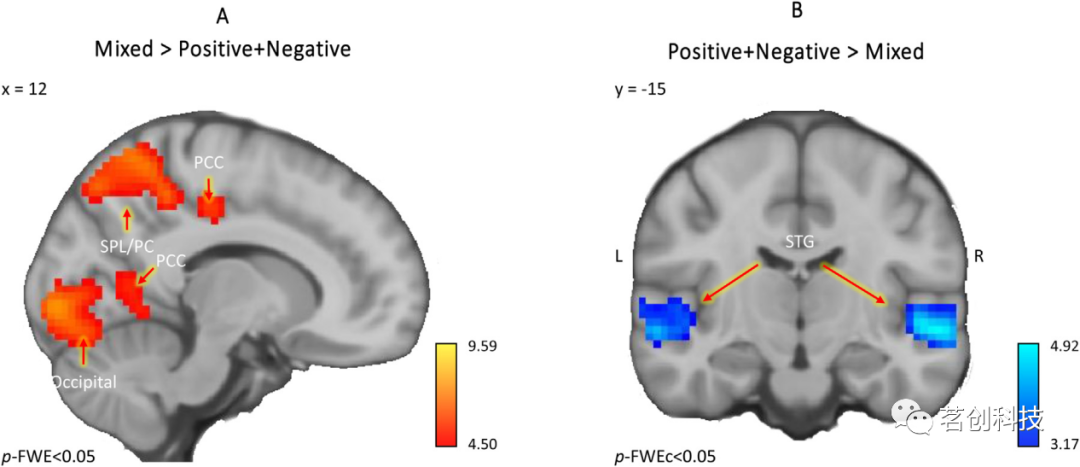
图2.混合情绪的主效应。(A)与积极和消极的电影片段相比,混合情绪电影片段引发血氧水平依赖(BOLD)活动明显升高(p-FWE<0.05,k=00体素)的区域。(B)与混合情绪电影片段相比,积极和消极电影片段引发BOLD活动显著升高(p-FWE<0.05,k=293体素)的区域。颜色条表示t值。
表1.混合情绪主效应。
根据本研究的第一个目的,接下来考察混合情绪和纯粹情绪在激活特异性方面是否存在差异。因此,本研究进行了双样本t检验,分别比较了混合情绪与积极情绪电影片段,以及混合情绪与消极情绪电影片段。当比较混合情绪和积极情绪电影片段时,结果发现SFG和MFG、PCC、楔前叶、SPL和脑干内具有明显和强大的神经活动(p-FWE<0.05)(图3Ai,表2A)。与消极情绪电影片段相比,混合情绪电影片段仅在枕叶内引起了明显更大的神经活动(p-FWE<0.05)(图3Bi,表2C)。相反,当与混合情绪电影片段对比时,积极情绪电影片段在MTG、杏仁核、后脑岛和外侧眶额皮层引发了更多的神经活动(p-FWE<0.05),而消极情绪电影片段的结果不显著。因此,这些数据显示了混合片段和积极片段之间有着较大的神经差异,而混合片段和消极片段之间的差异几乎很小。
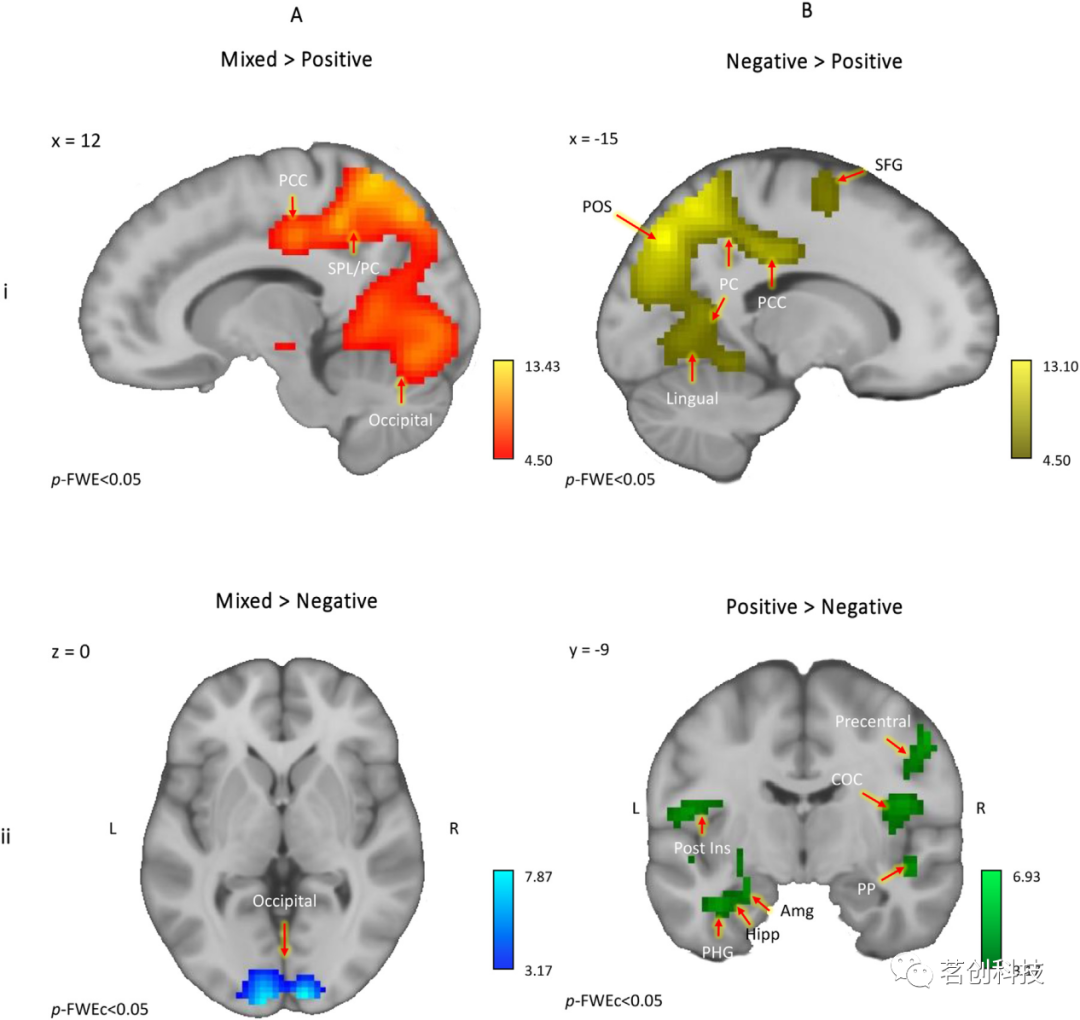
图3.混合情绪和效价效应。
表2.混合情绪和效价效应。
最后,本研究观察到了效价效应,即消极(相对于积极)电影片段在MFG、背外侧前额叶皮层(dLPFC)、中央前回、SFG脑干、颞下回、小脑和顶枕沟延伸到SPL楔前叶、PCC和舌回(PCC)内的神经活动显著增加(p-FWE<0.05,图3Bi,表2C)。相反,相对于消极情绪电影片段,积极情绪电影片段在颞极、海马旁回、海马延伸到杏仁核、中央前回、后脑岛、MTG和STG内引起了明显更大的神经活动(p-FWEc<0.05,图3Bii,表2D)。
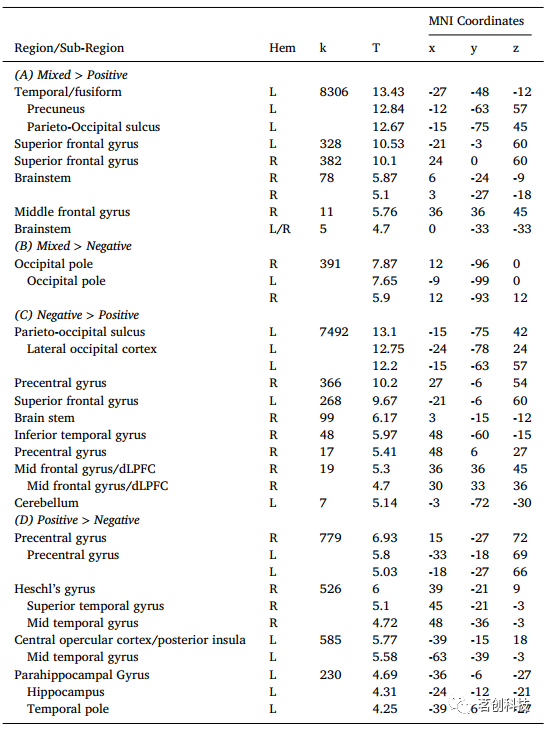
参数调节(PMOD)。本研究在所有四种条件下都观察到愉悦的主效应,愉悦的增加与颞极、中央前回、杏仁核/海马、MTG和STG以及角回内的神经活动增加显著相关(p-FWE<0.05)(图4Ai)。相反,愉悦感的降低与楔叶、上丘脑皮层和外侧枕叶皮层的激活增加相关(p-FWEc<0.05)(图4Bi)。厌恶感与中央前回、额下回、SFG脑干、梭状回、小脑以及向楔前叶和PCC延伸的顶枕沟呈正相关(p-FWE<0.05,图4Aii),而与中央前回、中央岛盖皮层和后脑岛呈负相关(p-FWEc<0.05,图4Bii)。最后,MinFeel与SPL、楔前叶、PCC和前运动皮层呈正相关(p-FWE<0.05)(图4Aiii)。MinFeel无显著负相关关系。
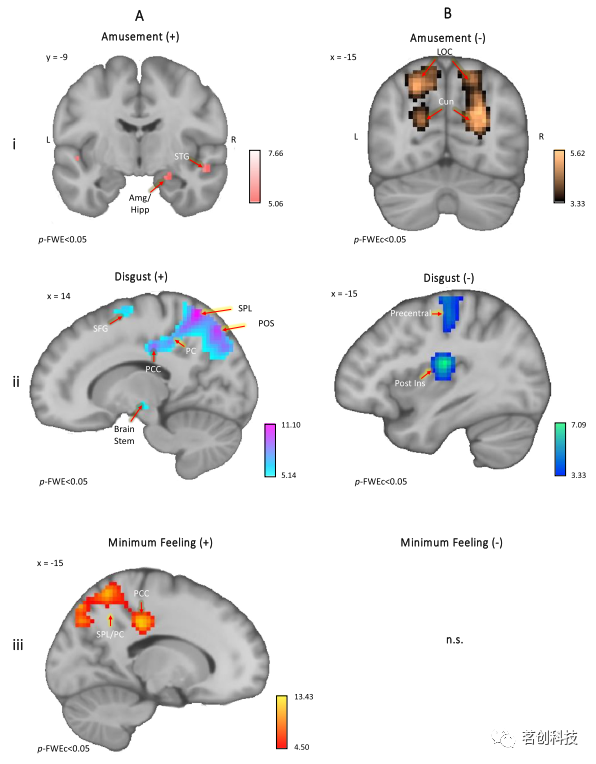
图4.PMODs的主效应。
最后,本研究对比了不同类型电影片段的参数调节效应:混合>积极+消极作为不同感觉得分的函数。当比较混合情绪电影和纯(积极+消极)情绪电影片段时,较高的愉悦评分与楔前叶/SPL活动增加相关(p-FWE<0.05)(图5A),而无显著负相关关系。然而,对于厌恶评分,在愉悦电影片段中观察到了地板效应,即一些参与者对这些电影的厌恶感评分是最低的(即1),从而无法将愉悦条件下的厌恶感与其他条件下(例如,混合-厌恶>积极-厌恶)的厌恶进行对比。因此,为了测量混合情绪作为厌恶函数的神经特异性,相对于消极电影片段,本研究对比了混合-厌恶和消极-厌恶评级的参数效应,结果是没有显著的激活,反之亦是。这表明,由厌恶感调节的BOLD反应的变化通常在混合和消极(即厌恶)电影片段之间共享。
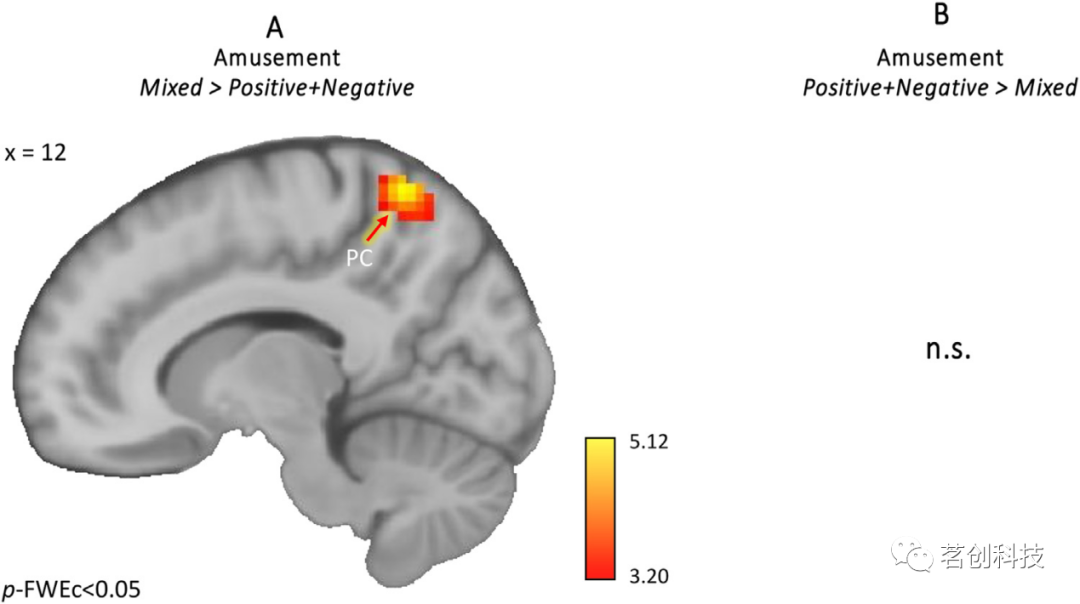
图5
结论
本研究结果显示,与明确情绪(主要是愉悦或主要是厌恶)相比,社交环境中的混合情绪(即愉悦和厌恶)在楔前叶/SPL和PCC中产生了显著的激活。这表明,该区域的BOLD反应是作为经历的混合情绪(同时感到愉悦和厌恶)的函数而增加的。此外,神经对模糊性的反应模式也与厌恶加工有部分重叠,因此这可能表明,混合情绪的神经表征反映的是一种纯粹的组成情绪,而不是某种情绪本身。尽管如此,未来的研究应该考虑到在处理厌恶或模糊时的执行需求可能会增加。混合情绪神经区域内的活动表明,对观点采择、认知灵活性、情境整合以及可能涉及消除相对复杂的社会情绪加工的需求增加。楔前叶/SPL可能是促进执行和注意过程的关键。此外,在复杂的社会和情感情景线索存在的动态情境中,PCC也可能有助于消除模糊性。综上所述,这些发现可能有助于未来的临床研究,以解开社会模糊性加工中潜在的神经机制,通常见于社交焦虑等障碍。据所知,本研究结果首次揭示了参与动态社会模糊处理中的专用神经过程。这表明在处理混合情绪的社交场景中可能需要高阶层(SPL)和低阶层(PCC)共同参与加工过程。
原文:Ryan J. Murray, Sylvia D. Kreibig, Corinna Pehrs, Patrik Vuilleumier, James J. Gross, Andrea C. Samson, Mixed Emotions to Social Situations: An fMRI Investigation, NeuroImage (2023), doi: https://doi.org/10.1016/j.neuroimage.2023.119973
